Este es un capítulo de El Libro de Neurología de colaboración
Las malformaciones arteriovenosas pueden aparecer en cualquier lugar en el sistema nervioso central, en este artículo, me centraré en los en el cerebro. Las pequeñas arterias que participan en las malformaciones arteriovenosas son deficientes en la capa de músculo liso de 1 . La maraña anormal de las arterias y las venas de la malformación 2,3,4,5,6,7 (a menudo referida como la malformación arteriovenosa nido) están conectados por una fístula o, más comúnmente, las fístulas varios. El directo arteriovenosa resultados conexión en alta presión canales vasculares, sobre todo en las venas con un engrosamiento fibromuscular y elástica incompetente lámina, estas venas están en riesgo de ruptura, a menudo con catastróficosresultados.
El signo más común de presentación de una malformación arteriovenosa es la hemorragia intracerebral (que ocurren en 42 a 72% de los clínicamente evidentes malformaciones arteriovenosas). A primera hemorragiaocurre más comúnmente en pacientes de entre 20 y 40 años de edad 2,3,4 . Los datos son contradictorios en relación con las asociaciones entre la edad y el riesgo de hemorragia, ya sea con estudios que informaron un mayor riesgo en pacientes de edad avanzada, en pacientes más jóvenes, o en ambos (picos bimodales) o un riesgo constante en el tiempo 4,5,8,9 . El sexo no parece influir en el riesgo de ruptura 6,10,11. Hemorragia de las cuentas de las malformaciones arteriovenosas de aproximadamente el 2% de todos los ictus 10,12 . Otros signos de presentación de arteriovenosas malformaciones incluyen convulsiones, efecto de masa (de compresión directa o inflamación relacionados de la malformación, ejerciendo presión sobre las estructuras circundantes), y robar isquémico (debido a la preferencia de baja resistencia al flujo sanguíneo a través de la malformación arteriovenosa, que resulta en la hipoperfusión de estructuras adyacentes). Incluso en ausencia de sangrado, dolor de cabeza (especialmente migrañas) se han asociado con malformaciones arteriovenosas13 .
La prevalencia de malformaciones arteriovenosas se estima en aproximadamente 0.01% de la población general, pero informó de las tasas oscilan entre el 0,001% al 0,52% 3,10,11,14,15 . Las lesiones se cree que su origen es congénito. A pesar de casos aislados se asocian a otras anomalías (por ejemplo, síndrome de Osler-Weber-Rendu enfermedad y el síndrome de Sturge-Weber 16,17 ), arteriovenosa malformaciones no son considerados como familiares, y la abrumadora mayoría de los casos son esporádicos.
El aumento del uso de tecnologías avanzadas de imágenes ha llevado a la identificación de las malformaciones arteriovenosas más, incluyendo muchas que son asintomáticos 11 . En este artículo se centra en la gestión de una malformación arteriovenosa, ya sea sintomática o dicho sea de paso descubrió, en los adultos. El tratamiento a corto plazo de la rotura de las malformaciones arteriovenosas es más allá del alcance de este artículo.
Estrategias y evidencia
Evaluación
Imágenes
Las malformaciones arteriovenosas pueden ser visualizados con el uso de la tomografía computarizada (TC) o la angiografía por tomografía computarizada (CTA), la resonancia magnética (RM) o la resonancia magnéticaangiografía (ARM) o angiografía por catéter. Las tomografías computarizadas son sensibles en la detección de la hemorragia aguda, pero otras técnicas de imagen son necesarios para proporcionar una visión detallada de la malformación arteriovenosa. CTA ofrece mejores detalles vascular de MRA, mientras que la RM y ARM permiten una mejor visualización de la relación de los arteriovenosa malformación alrededor de las estructuras cerebrales. Información adicional se puede obtener con el uso funcional de resonancia magnética, para identificar elocuente (o funcional) del tejido cerebral, y de imagen con tensor de difusión, para identificar importantes de la materia blanca extensiones. La angiografía sigue siendo la norma para evaluar la arquitectura de las malformaciones arteriovenosas, incluyendo la presencia o ausencia de los aneurismas asociados, presencia o ausencia de obstrucción del flujo venoso, y el patrón de drenaje venoso. Los riesgos asociados con la angiografía incluyen apoplejía, lesión arterial, y reacciones con medio de contraste, pero latasas son inferiores al 1%. tridimensional MRA, disponible en algunos centros, puede proporcionar detalles adicionales para orientar las intervenciones, como puede tridimensional angiografía.
Evaluación de Riesgos
Una vez que una malformación arteriovenosa se identifica, la gestión de las decisiones son tomadas por el peso de los riesgos de dejar la malformación no tratados frente a los riesgos de la intervención. Actualmente hay ningún dato proveniente de ensayos controlados aleatorios como para guiar la toma de decisiones. Más bien, estas decisiones deben basarse en datos de observación respecto a los resultados de la intervención y los que no.
Si no se trata de Historia Natural de malformaciones arteriovenosas
Un estudio de autopsia concluyó grande que el 12% de las malformaciones arteriovenosas se vuelven sintomáticos durante la vida del paciente 14,19 , mientras que otros estudios han sugerido que la mayoría de las malformaciones que sangran al menos una vez 3,5 . Estas discrepancias pueden estar relacionadas a los datos incompletos de los eventos hemorrágicos en los estudios de autopsia o la sobrestimación del riesgo de sangrado en los estudios que no basado en la población. El riesgo general de la hemorragia de arteriovenosasmalformaciones se estima en 2 a 4% por año 5,6,8,20 , y la hemorragia se asocia con una probabilidad del 5 al 10% de la muerte y una probabilidad del 30 al 50% de discapacidad neurológica permanente o déficit. 3
Después de una hemorragia inicial, el riesgo anual de una posterior hemorragia se ha informado a la gama de 4,5 a 34,4% 4,5,6,21,22 ; la mejor estimación es de aproximadamente 6% durante el primer año, con un retorno a la línea de base riesgo después 8,23 . En un estudio prospectivo de estudio de 622 pacientes con malformaciones arteriovenosas que fueron seguidos durante una media de 2,3 años, el riesgo anual de hemorragia con el tratamiento conservador fue de 5,9% entre los pacientes que se presentaron con hemorragia (45,3% del grupo), en comparación con el 1,3% entre los que no. 6 Varias características específicas de una malformación arteriovenosa también puede predecir un mayor riesgo de hemorragia, incluyendo la presencia de aneurismas (alimentación arteria, intranidal o venosa), en el drenaje venoso profundo senos, localización profunda (es decir, basal ganglios, cápsula interna, tálamo, o cuerpo calloso), una sola vena de drenaje, y venosa estenosis y, además, algunos datos, pero no todos, sugieren que el riesgo aumenta con la disminución de diámetro de la malformación 6,24,25,26,27 . Aneurismas arteriales, lo que puede ocurrir en cualquier segmento de la alimentación de las arterias, también se puede romper y hemorragia. Cuanto más grande sea el aneurisma, mayor será el riesgo de ruptura de 20,28 .
Sin embargo, los datos son contradictorios con respecto a algunos de estos supuestos factores de riesgo4,6,8,27,29 . Por ejemplo, en el estudio prospectivo, longitudinal estudio se señaló anteriormente, 6 tres características - una hemorragia anterior, el drenaje venoso profundo, y la ubicación de profundidad - fueron significativas, los predictores independientes de riesgo de la hemorragia de una fístula arteriovenosamalformación. El riesgo anual de hemorragia antes de una malformación arteriovenosa roto fue del 1% si ninguno de los otros dos factores estuvo presente, el 3% si uno estaba presente, y el 8% si ambos estuviesen presentes, los riesgos correspondientes anual de hemorragia antes de la ruptura de las malformaciones arteriovenosas fueron del 5%, 11% a 15, y 35%, respectivamente. Sin embargo, ni la presencia de aneurismas relacionados con la malformación arteriovenosa (intranidal o arteria que alimenta), ni el diámetro de la malformación (más grande o más pequeño) se asoció con un aumento significativo del riesgo de hemorragia durante el período de seguimiento de esta cohorte. En el estudio, los aneurismas relacionados con malformación arteriovenosa se asocia con hemorragia en la presentación, por lo que la falta de asociación entre los aneurismas y hemorragias posteriores pueden reflejar un sesgo de selección (es decir, que los pacientes con aneurismas de sangrado relacionado con malformaciones arteriovenosas setratan rápidamente y que los que posteriormente fueron seguidos de forma prospectiva se encontraban en la reducción del riesgo de ruptura).
Administración
En los casos en que se considera el riesgo de hemorragia lo suficientemente alta para justificar la intervención (teniendo en cuenta las características de la malformación arteriovenosa edad y preferencias del paciente, y la presentación), las opciones de tratamiento incluyen la resección quirúrgica, la radiocirugía o embolización (o una combinación de de estos, en algunos casos). Ensayos que comparan directamente estos enfoques con un sí o con la observación faltan, e información sobre los resultados se deriva en gran parte de series de casos. Participación de un equipo multidisciplinario con experiencia en neurocirugía, endovascular de intervención, y se recomienda la radioterapia, para ofrecer todas las opciones terapéuticas.Obliteración completa de la arteriovenosa malformación es el objetivo del tratamiento, ya obliteración parcialparece ofrecer poca o ninguna protección de la hemorragia y puede en realidad aumentar el riesgo.
La resección quirúrgica
La resección quirúrgica tiene la ventaja de resultar en la inmediata curación de la malformación arteriovenosa, pero hay riesgos asociados con la cirugía, e incluso si el riesgo es muy bajo, la cirugía no es apropiada en todos los casos. Decisiones en cuanto a que las lesiones son más susceptibles a la cirugía se basan generalmente en la escala de Spetzler-Martin, 30 que se utiliza para calificar arteriovenosa malformaciones en la base de tres características que han demostrado ser predictivo de los resultados quirúrgicos: el diámetro máximo de la malformación arteriovenosa, su ubicación (dentro o fuera de la corteza elocuente), y la presencia o ausencia de trombosis venosa profunda de drenaje. Cuanto mayor sea el grado (la suma de las puntuaciones de estas tres características), el más complejo y arriesgado de la cirugía el tratamiento de la lesión. Dependiendo de la edad y la salud general de las características del paciente y otros de la arteriovenosa malformación, los pacientes con grados I a III malformaciones arteriovenosas se ofrecen generalmente la resección quirúrgica (por las lesiones de grado III, a menudo después de la embolización). En series de casos, las tasas de debilidad o parálisis permanente, afasia, hemianopsia y son 0 a 15%, y la mayoría no reportan muertes. 31,32 En contraste, la cirugía de resección se ha asociado con tasas mucho mayor de complicaciones y muerte en pacientes con grado IV o malformaciones arteriovenosas V, este método es lo que elude a menudo. 31,33,34
Radiocirugía
La radiocirugía generalmente se recomienda si una malformación arteriovenosa es inferior a 3 cm de diámetro y se encuentra en un elocuente área en la que la cirugía puede causar un déficit neurológico. A pesar de la radiocirugía evita una craneotomía, una desventaja es que hay un período de latencia de aproximadamente 1 a 3 años desde el momento del tratamiento a la obliteración potencialmente completa de la malformación arteriovenosa, tiempo durante el cual se sigue que el riesgo de hemorragia. Por otra parte, un estudio grande, prospectivo de 500 pacientes (mediana de seguimiento, 7,8 años) 35 demostró que el riesgo de hemorragia se redujo considerablemente (un 88%), pero no eliminado, después de la obliteración, en comparación con antes de radiocirugía tratamiento, de acuerdo con estudios de imagen. 35 Las tasas de curación para el rango de radiocirugía 81 a 90% para lesiones de menos de 3 cm de diámetro, con tasas de curación más baja para las lesiones más grandes 35,36,37 (en una serie, 69% para las lesiones por lo menos 3 cm de de diámetro).
Las tasas de complicaciones son variables y dependen de la radiación de dosis. Las complicaciones tempranas incluyen convulsiones, náuseas, vómitos, y dolores de cabeza, la mayoría de los cuales son auto-limitados. Complicaciones tardías, lo que puede ocurrir semanas o años después del tratamiento, las convulsiones, hemorragia, radionecrosis, edema progresivo, y la congestión venosa, en casos raros, pueden amenazar la vida. Un reciente serie una incidencia del 5,2% de deterioro neurológico transitorio , con una incidencia del 1,4% de déficit neurológico permanente 35 . El más grande de la lesión, en particular los mayores de 3 cm de diámetro, mayor será la probabilidad de estas complicaciones y menor será la probabilidad de la cura de la arteriovenosa malformación 35,36,37,38,39 . Recientemente, prometedores resultados preliminares se han reportado lesiones de mayor tamaño (entre ellos los de grado IV y V grados) con el uso de la radiocirugía etapas, que se enfoca en los diferentes componentes de la malformación arteriovenosa durante las diferentes sesiones 40 .
Embolización
La embolización consiste en la oclusión del flujo sanguíneo a una fístula arteriovenosa malformación mediante el uso de catéteres endovasculares para depositar oclusiva materiales en las arterias que alimentan y nido. La embolización puede ser curativa en una minoría de casos, sobre todo en lesiones de menos de 1 cm de diámetro que se alimentan de una sola arteria. 41,42 tasas de obliteración mejorada (de aproximadamente 20%) han sido reportados para el uso de una embolia desarrollado recientemente agente (Onyx), 42 que puede permitir el despliegue aparentemente más seguro y eficaz de esta cola. Las complicaciones de la embolización de la arteriovenosa malformación se han reportado en 6-14% de los casos, la mayoría de las complicaciones son problemas menores relacionados con el cateterismo, pero una hemorragia mayor, infarto cerebral y la muerte han sido reportados. 42,43,44
Manejo de aneurismas asociados a malformación arteriovenosa
Los aneurismas se encuentran hasta en el 58% de los pacientes con arteriovenosa malformación. Manejo de los aneurismas varía, dependiendo de su ubicación y el diámetro. Si el aneurisma es una arteria que no alimenta la malformación arteriovenosa, que es gestionado de manera similar a los aneurismas intracraneales en los pacientes sin arteriovenosa malformación. Los casos de un aneurisma en una arteria que alimenta la malformación arteriovenosa son más complejas. Arteria que alimenta- aneurismas de menos de 5 mm de diámetro han sido reportados a regresar después del tratamiento de la malformación arteriovenosa, en algunos casos 28 , pero en otros casos, a la ruptura después del tratamiento, debido probablemente al aumento resultante en la presión transmural 46 . Dada la preocupación sobre la posible ruptura, la saturación de microcirugía o endovascular del aneurisma de la espiral, en particular si es superior a 7 mm de diámetro de24 , se realiza con frecuencia antes del tratamiento de la arteriovenosa malformación. Dada su ubicación dentro de la lesión, los aneurismas intranidal son tratados en conjunto con el arteriovenosa malformación.
Terapia multidisciplinar
Aunque los datos son limitados, el uso del tratamiento de más de un método parece ser útil en pacientes seleccionados. La embolización se utiliza a menudo para reducir el flujo de sangre a una malformación arteriovenosa, en preparación para la resección quirúrgica. La reducción del flujo, especialmente la aportada por la alimentación profunda arterias, reduce los riesgos asociados con la cirugía 7,44 . Los pacientes que tienen malformaciones arteriovenosas que tienen una hemorragia puede También tienen un beneficio a corto plazo de la embolización de la selección de componentes específicos de la malformación que es probable que el sitio de la hemorragia (por ejemplo, un aneurisma asociado), la cirugía puede ser realizada cuando se resuelve la inflamación asociada. En algunos casos, como para las grandes malformaciones arteriovenosas, la radiocirugía se ha utilizado también como un complemento a cualquiera de embolización parcial o resección parcial.
Áreas de incertidumbre
Que los pacientes con malformaciones arteriovenosas deben ser tratados y la mejor manera de tratar a permanecer 7,33,41,47 uncertain.The influencia de muchas variables en la historia natural de las malformaciones arteriovenosas es controversial, hay incertidumbre en particular con respecto a los efectos del diámetro de la malformación arteriovenosa, la presencia o ausencia de los aneurismas asociados, y la edad a la presentación sobre el riesgo de hemorragia. Además, la disponibilidad de métodos de tratamiento, así como la experiencia con su uso, varía entre los centros y los médicos. Los datos de los ensayos aleatoriospara guiar las decisiones de gestión de la actualidad se carece. Un curso multicéntrico aleatorizado, un ensayo aleatorizado de no roto malformaciones arteriovenosas cerebrales (ARUBA), se compara el tratamiento de las lesiones no roto con el tratamiento conservador de los mismos. La heterogeneidad de la enfermedad y los métodos de tratamiento utilizados tienen que ser considerados en la aplicación de los resultados de la prueba, una vez que estén disponibles para los pacientes individuales.
Algunos informes sugieren que el riesgo de ruptura de una fístula arteriovenosa malformación puede aumentar durante el embarazo 48,49 . Aunque el tratamiento de las malformaciones arteriovenosas roto no es general, se recomienda durante el embarazo, las mujeres embarazadas que se presentan con hemorragia de una malformación arteriovenosa parecen estar en alto riesgo de resangrado, que presta apoyo a una fuerteconsideración de tratamiento durante el embarazo. 33,50
Directrices de las Sociedades Profesionales
Un grupo de estudio del Consejo de Carrera de la American Stroke Association publicó recomendaciones en 2001 para el manejo de las malformaciones arteriovenosas cerebrales. Las recomendaciones se basan en la consideración de la historia conocida de la arteriovenosa malformación y los riesgos asociados con diferentes publicado métodos de tratamiento. 33 consideración fuerte de la cirugía se recomienda para las lesiones de Spetzler-Martin grado I y grado II, y la consideración de la embolización endovascular seguido por microcirugía se recomienda para las lesiones de grado III. Consideración de la radiocirugía se recomienda para las lesiones que pueden estar asociados con un mayor índice de complicaciones quirúrgicas, debido a su localización anatómica o la anatomía de la alimentación de los vasos, en particular para las lesiones en elocuente tejidos. Debido a los riesgos del tratamiento, grado IV y grado V lesiones generalmente no son tratados.
Resumen y recomendaciones
En un paciente padece una malformación arteriovenosa en los estudios de imagen, como el que se describe en la viñeta del caso, la angiografía está indicada para definir con mayor precisión la lesión y para evaluar las características que pueden estar asociados con un mayor riesgo de hemorragia. Aunque los datos de los ensayos aleatorios para guiar la elección de la intervención se carece de tratamiento (quirúrgico de resección, la radiocirugía, embolización o una combinación de estos) generalmente se considera apropiada para las malformaciones arteriovenosas que son de grado I a III. 24,33 La elección del tratamiento dependerá de las características específicas de la lesión, con la consideración de la edad del paciente, la presencia o ausencia de sangrado y los aneurismas asociados, diámetro y ubicación de los aneurismas asociados, y el patrón de drenaje venoso. Dada la complejidad de no sólo el tratamiento, sino también de las decisiones sobre el mejorcurso del tratamiento, los pacientes deben ser atendidos en centros con experiencia en los métodos de tratamiento diferentes. En el caso descrito en la viñeta caso, que tiene una malformación arteriovenosa 3,5 cm de diámetro y un aneurisma asociado, le recomiendo recorte de microcirugía inicial del aneurisma, seguida por embolización de la arteria principal de alimentación y, a partir de entonces, la resección microquirúrgica de la malformación arteriovenosa.
Manejo actual de las malformaciones arteriovenosas. Estudio retrospectivo de 31 casos y revisión de la literatura
RESUMEN
Objetivos. Establecer unos criterios terapéuticos en las malformaciones arteriovenosas (MAVs) grados III, IV y V de Spetzler y Martin y análisis de resultados en el subgrupo de tratamiento con embolización más cirugía.
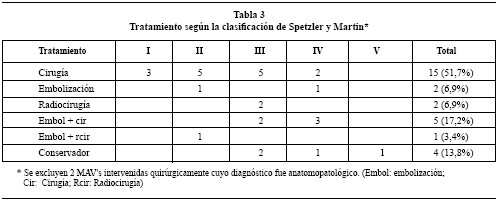
Material y métodos. Estudio retrospectivo de 31 pacientes con MAVs cerebrales tratados en nuestro servicio entre 1999 y 2004. Se trata de 19 mujeres y 12 hombres, con una edad media de 31,6 años (rango de 1 a 62a). La forma de presentación fue en un 77,4% hemorragia intracraneal, en un 12,9% crisis comicial y en un 3,2% cefalea, infarto isquémico y hallazgo casual en cada uno de ellos. En 29 casos se realizó arteriografía diagnóstica y en 2 casos el diagnóstico fue anatomopatológico. Según la clasificación de Spetzler y Martin, 10,3% fueron de Grado I, 24,1% de Grado II, 37,9% de Grado Ill, 24,1% de Grado IV y 3,4% de Grado V. Se clasificaron en 6 grupos según el tratamiento realizado (cirugía, embolización, radiocirugía, embolización más cirugía, embolización más radiocirugía y tratamiento conservador).
Resultados. Las MAVs grado III, IV y V (19 pacientes) fueron tratadas en su mayoría por cirugía (6 casos) y embolización más cirugía (5 casos) pero también se utilizaron otras modalidades de tratamiento (embolización, radiocirugía y conservador). Los resultados funcionales de estos 3 subgrupos muestra un 36,8% (7 casos) de asintomáticos o con mínimos síntomas (Rankin m 0-1), un 52,6% (10 casos) de discapacidad leve pero independientes (Rankin m=2), un 5,3% (1 caso) de moderada discapacidad (Rankin m=3), y un 5,3% (1 caso) de mortalidad. En el manejo combinado embolización más cirugía de malformaciones complejas, se observa un alto porcentaje de sangrado postembolización que motivó cirugía precoz con buen resultado funcional. Hubo un caso de mortalidad postquirúrgica.
Conclusiones. En el tratamiento de las MAVs cerebrales se debe tener en cuenta factores como la historia natural, la forma de presentación (hemorragia), las características angioestructurales (presencia de aporte arterial profundo, aneurismas), la escala de Spetzler y Martin y el estado clínico En el tratamiento con embolización más cirugía es recomendable obtener una embolización prequirúrgica subtotal > 50%, no ocluir más del 50% por sesión, mantener un intervalo entre sesiones de embolización entre 4 y 6 semanas y un intervalo entre última embolización y cirugía entre 1 y 3 semanas.
Material y métodos. Estudio retrospectivo de 31 pacientes con MAVs cerebrales tratados en nuestro servicio entre 1999 y 2004. Se trata de 19 mujeres y 12 hombres, con una edad media de 31,6 años (rango de 1 a 62a). La forma de presentación fue en un 77,4% hemorragia intracraneal, en un 12,9% crisis comicial y en un 3,2% cefalea, infarto isquémico y hallazgo casual en cada uno de ellos. En 29 casos se realizó arteriografía diagnóstica y en 2 casos el diagnóstico fue anatomopatológico. Según la clasificación de Spetzler y Martin, 10,3% fueron de Grado I, 24,1% de Grado II, 37,9% de Grado Ill, 24,1% de Grado IV y 3,4% de Grado V. Se clasificaron en 6 grupos según el tratamiento realizado (cirugía, embolización, radiocirugía, embolización más cirugía, embolización más radiocirugía y tratamiento conservador).
Resultados. Las MAVs grado III, IV y V (19 pacientes) fueron tratadas en su mayoría por cirugía (6 casos) y embolización más cirugía (5 casos) pero también se utilizaron otras modalidades de tratamiento (embolización, radiocirugía y conservador). Los resultados funcionales de estos 3 subgrupos muestra un 36,8% (7 casos) de asintomáticos o con mínimos síntomas (Rankin m 0-1), un 52,6% (10 casos) de discapacidad leve pero independientes (Rankin m=2), un 5,3% (1 caso) de moderada discapacidad (Rankin m=3), y un 5,3% (1 caso) de mortalidad. En el manejo combinado embolización más cirugía de malformaciones complejas, se observa un alto porcentaje de sangrado postembolización que motivó cirugía precoz con buen resultado funcional. Hubo un caso de mortalidad postquirúrgica.
Conclusiones. En el tratamiento de las MAVs cerebrales se debe tener en cuenta factores como la historia natural, la forma de presentación (hemorragia), las características angioestructurales (presencia de aporte arterial profundo, aneurismas), la escala de Spetzler y Martin y el estado clínico En el tratamiento con embolización más cirugía es recomendable obtener una embolización prequirúrgica subtotal > 50%, no ocluir más del 50% por sesión, mantener un intervalo entre sesiones de embolización entre 4 y 6 semanas y un intervalo entre última embolización y cirugía entre 1 y 3 semanas.
Palabras clave: Malformaciones arteriovenosas cerebrales. Cirugía. Embolización. Historia natural.
Introducción
Durante 25 años, desde 1980 al 2004, se han intervenido quirúrgicamente 80 malformaciones cerebrales (MAVs) en nuestro servicio. A lo largo de todo este periodo, el modo de tratar una MAV ha variado de una manera progresiva conforme han evolucionado las distintas opciones terapéuticas. El tratamiento quirúrgico ha mejorado sus resultados con la mayor experiencia en técnica microquirúrgica, mayor información aportada por los medios diagnósticos (arteriografías, resonancias magnéticas funcionales, neuronavegación, mapeo cortical), mejores materiales (hemoclips), etc. El tratamiento endovascular ha experimentado importantes avances en su técnica (microcateterismos superselectivos), han aparecido nuevos materiales de embolización, lo que ha permitido el tratamiento de lesiones vasculares cada vez más complejas. También la radiocirugía ha evolucionado hacia una tecnología más avanzada y conocimientos más precisos enfocados al tratamiento de las MAVs.
En nuestro centro, disponemos de un servicio de Neurorradiología Intervencionista desde 1999, lo cual ha motivado que esta revisión incluya las MAVs cerebrales tratadas desde entonces.
La evolución de las técnicas terapéuticas ha contribuido a modificar los criterios de tratamiento de las MAVs. Si nos basamos en la clasificación de Spetzler y Martin40 (S-M), observamos que las de grado I y II se tratan básicamente con cirugía14,19,31,32. Las grado V, la mayoría de autores abogan por tratamiento conservador15,20,31,32,39. Sin embargo, en los grado III y IV, dada su heterogeneidad, no hay un criterio de indicación terapéutica bien definido. En nuestra serie, precisamente estos dos subgrupos son los que muestran mayor variabilidad en el tipo de tratamiento utilizado.
En estos 5 años de experiencia en el manejo combinado de tratamiento endovascular y quirúrgico de las MAVs, hemos observado una gran variabilidad de criterios en la forma de realizar dicho tratamiento tanto en nuestro centro como en lo publicado en la literatura hasta la fecha.
Material y métodos
Un total de 31 pacientes con MAVs cerebrales fueron tratados en nuestro centro entre los años 1999 y 2004. De ellos, 19 fueron mujeres y 12 hombres, con una edad media de 31,6+/-14,5 años en un rango de 1 a 62 años. En 27 (87%) de estos pacientes las MAVs fueron supratentoriales (14 de hemisferio derecho y 13 izquierdo) y 4 (13%) fueron infratentoriales (ver tabla 1). La forma de presentación durante el periodo de estudio fue hemorragia intracraneal en 24 pacientes (77,4%), crisis comicial en 4 (12,9%), cefalea en 1 (3,2%), infarto isquémico en 1 (3,2%) y hallazgo casual en 1 (3,2%) (ver tabla 2). En los casos que se presentaron con sangrado, según la escala de Hunt y Hess23 al ingreso, 7 pacientes (29,2%) se encontraban en grado I, 3 (12,5%) en grado II, 2 (8,3%) en grado III, 10 (41,6%) en grado IV y 2 (8,3%) en grado V. En 29 casos se realizó arteriografía diagnóstica y se pudo agrupar mediante la clasificación de Spetzler y Martin en los siguientes grupos: 3 (10,3%) fueron de Grado I, 7 (24,1%) de Grado II, 11 (37,9%) de Grado III, 7 (24,1%) de Grado IV y 1 (3,4%) de Grado V (ver tabla 2). En 2 casos se obtuvo el diagnóstico mediante examen anatomopatológico, dado que fueron tratadas mediante intervención quirúrgica urgente sin poderse realizar arteriografía.
Las diferentes MAVs se agrupan en 6 grupos diferentes según la actitud terapéutica tomada: 15 (51,7%) tratamiento quirúrgico, 2 (6,9%) embolización, 2 (6,9%) radiocirugía, 5 (17,2%) embolización más cirugía, 1 (3,4%) embolización más radiocirugía y 4 (13,8%) tratamiento conservador (ver tabla 3). El material utilizado en el tratamiento endovascular para embolización fue en la mayoría de los casos el Glubran® (mezcla de N-butyl-2-cianoacrilato más metacrilosisolfolano). Los pacientes que fueron tratados con radiocirugía fueron trasladados a otro centro.
Los resultados se evalúan a partir de la escala funcional Rankin modificado36,45 (Rankin m) al año de seguimiento (Ver tabla 4).
Resultados
Mortalidad global y por sangrado
Nuestra población de estudio presenta una mortalidad global del 6,5% (2 de 31 pacientes). Uno de los casos, falleció tras debutar con una hemorragia masiva que se intentó drenar por cirugía urgente sin éxito. El otro caso presentó un hematoma postoperatorio falleciendo a las 3 semanas (figura 1).

Figura 1. Mujer de 59 años que ingresa por hemorragia intraventricular
(foto A). En angiografía se observa MAV frontoparietal derecha grado IV de S-M
(fotos B y C). Presenta fenómenos de robo de arteria cerebral anterior derecha,
un aneurisma intranidal y dilatación de la vena de drenaje. Se decide realizar
una sesión de embolización donde se consigue ocluir un 30% aproximadamente
(fotos D y E). Se interviene quirúrgicamente de forma electiva realizándose
la exéresis macroscópica total de la MAV. En el postoperatorio inmediato,
la paciente presenta una hemiparesia izquierda densa y a las 48h presenta
disminución del nivel de consciencia. En la TC craneal se observa hematoma
en lecho quirúrgico (foto F). La paciente presenta una evolución tórpida siendo
éxitus a las 3 semanas de la operación.
Exclusión completa de la MAV
De los 31 casos, en 4 pacientes se llevó a cabo tratamiento conservador y 2 pacientes fueros éxitus por lo que no podemos evaluar exclusión completa en dichos pacientes. Se consiguió la exclusión completa de la MAV confirmada por arteriografía en un 88% de los casos tratados (22/25).
En los 3 pacientes en los que no quedó completamente ocluida la MAV, se consiguió más del 90% de exclusión en 2 casos y en el otro un 50% aproximadamente.
En los pacientes tratados con radiocirugía se confirmó la exclusión completa mediante angiografía a los 2 años de tratamiento.
Resultados funcionales
Los resultados funcionales de toda la serie al año de seguimiento fueron de un 45,2% de asintomáticos o con síntomas leves (Rankin m 0-1), un 41,9% de discapacidad leve pero independientes (Rankin m=2), un 6,5% de discapacidad moderada (Rankin m=3) y un 6,5% de mortalidad (2 casos).
Según el tipo de tratamiento, la mayoría de grupos terapéuticos muestran unos resultados favorables (si consideramos como tal un Rankin ≤ 2), excepto 4 casos que corresponden: 2 al grupo de cirugía, 1 al de embolización más cirugía y el último al de tratamiento conservador.
En los subgrupos de MAVs grado III, IV y V, se muestra un 36,8% (7 casos) en Rankin m 0-1, un 52,6% (10 casos) en Rankin m=2, un 5,3% (1 caso) en Rankin m=3, y un 5,3% (1 caso) de mortalidad.
Según su forma de presentación, en los pacientes que debutaron con hemorragia se observa una tendencia a presentar un cierto grado de discapacidad (pacientes con Rankin m ≥ 2): un 78,6% (11/14) de pacientes con hemorragia versus un 20% (1/5) de pacientes que no se presentaron con sangrado (ver tabla 5).
También existe una tendencia a presentar discapacidad si la MAV se encuentra en área elocuente 10/16 (62,5%). No nos es posible comparar los resultados con las MAVs situadas en área no elocuente de estos grados (III, IV y V) debido al bajo número de casos resultante (3 pacientes) (ver tabla 6).
Grupo embolización más cirugía
De un total de 5 pacientes, 2 fueron clasificados en grado de S-M III y 3 fueron considerados grado IV. Los resultados funcionales fueron de 4 pacientes en Rankin m de 2 y 1 en Rankin m 6 (éxitus). Uno de ellos fue embolizado parcialmente en otro centro en 10 ocasiones e ingresó con un sangrado en nuestro hospital. Se intentó una nueva embolización en nuestro centro pero no fue posible la oclusión, por lo que se operó posteriormente. De los otros 4 que fueron embolizados en nuestro centro, se realizaron un total de 8 sesiones de embolización de forma electiva, en 2 de ellos se realizaron 3 sesiones y en otros 2 se realizó una sola sesión. El tiempo medio entre sesiones de embolización fue de 14,25+/-5,6 días. El tiempo entre embolización y cirugía tuvo lugar entre 1 y 13 días, motivado en la mayoría de los casos por la complicación del sangrado postembolización. La media de embolización prequirúrgica fue del 61,5+/-26,6% (un caso el 95%, 2 casos el 60% y un caso el 30%). De estos 4 pacientes, 3 presentaron sangrado postembolización: uno de los casos ocurrió tras la embolización en una sola sesión del 60% de la MAV, en otro caso sangró a los 6 días de ocluirse un 95% de la MAV (figura 2) y el otro caso sucedió en las primeras 24h tras la tercera sesión de embolización donde se ocluyó un 60% de la lesión. Dichos casos fueron tributarios de tratamiento quirúrgico precoz con drenaje del hematoma y exéresis de la MAV.


Figura 2. Varón de 35 años que debutó con hemorragia intraventricular (A).
En la angiografía cerebral se observa MAV parietal derecha grado III de S-M (B).
Presenta aneurismas intranidales y dilatación varicosa de vena de drenaje.
Se trata con varias sesiones de embolización: 1a sesión oclusión de un 40% (C),
2a sesión oclusión de un 80% y 3a sesión oclusión de un 95% sin conseguir
obliterar un microaneurisma intranidal (D). Seis días postembolización presenta
sangrado de la MAV con importante hematoma frontoparietal derecho (E).
Se interviene quirúrgicamente y se realiza evacuación del hematoma
y exéresis de la MAV. TC postoperatorio inmediato (F). En arteriografía de
control se observa una exéresis del 100% de la MAV (G).
En la angiografía cerebral se observa MAV parietal derecha grado III de S-M (B).
Presenta aneurismas intranidales y dilatación varicosa de vena de drenaje.
Se trata con varias sesiones de embolización: 1a sesión oclusión de un 40% (C),
2a sesión oclusión de un 80% y 3a sesión oclusión de un 95% sin conseguir
obliterar un microaneurisma intranidal (D). Seis días postembolización presenta
sangrado de la MAV con importante hematoma frontoparietal derecho (E).
Se interviene quirúrgicamente y se realiza evacuación del hematoma
y exéresis de la MAV. TC postoperatorio inmediato (F). En arteriografía de
control se observa una exéresis del 100% de la MAV (G).
Discusión
El tratamiento de las MAVs cerebrales debe partir del amplio conocimiento de su historia natural con el fin de determinar si ésta es mejorable mediante las medidas terapéuticas que tenemos actualmente. Los estudios al respecto muestran un riesgo de sangrado en las MAVs no tratadas del 2 al 4% anual2,6,11,13,35. Tras la primera hemorragia, hay una mortalidad del 10-30% y una morbilidad grave del 10-20%2,6,13,30,33,35. Sobre la recurrencia del sangrado, numerosos artículos muestran una recurrencia de hemorragia del 6 al 18% al año5,9,11,13,35. Todo ello depende de las características de la MAV en la que tendremos en cuenta como factores predictores de sangrado más significativos: la hemorragia previa, la presencia de aneurismas intranidales (según Redekop G37, el riesgo de hemorragia con aneurisma intranidal es del 9,8%) y el drenaje venoso profundo3,5,16,37.
En nuestra serie hemos observado que la hemorragia como forma de presentación es un importante factor que condiciona el resultado funcional final de nuestros pacientes. Un 78,6% de los pacientes que se presentaron con sangrado presentan Rankin m ≥ 2 frente a un 20% de los que no tuvieron hemorragia.
Por este motivo, creemos que para tomar una determinada actitud terapéutica o establecer un pronóstico de una MAV no debemos guiarnos únicamente por la clasificación de Spetzler y Martin. Coincidiendo con otros autores, se deben tener en cuenta también otros factores como son la forma de presentación (principalmente la hemorragia)6,11,13,30, la edad17, el estado clínico del paciente17,19,44 y las características angioestructurales de la MAV8,37 (aportes arteriales profundos, aneurismas intranidales).
Tanto en nuestra serie como en lo publicado en la literatura hasta la fecha, existen pocas dudas en tratar aquellas MAV grado I y II, dado que los resultados superan ampliamente los de la historia natural. El tratamiento de elección sería la cirugía, quedando en casos muy seleccionados (lesiones profundas) la radiocirugía y/o la embolización14,19,31,32. En las MAVs grado V se optaría por tratamiento conservador salvo casos muy seleccionados15,20,31,32,39.
En nuestra revisión y en la literatura existe una marcada variabilidad en la actitud terapéutica tomada para los grupos III, IV. Nuestro criterio terapéutico para dichos grupos vino determinado por el tamaño de la MAV (mayor o menor de 3cms), la localización (elocuencia), la clínica del paciente y las características angiográficas de la MAV.
En nuestra serie de MAVs grado III (11 pacientes), se decidió en 5 casos utilizar la cirugía, en 2 la embolización más cirugía, en 2 la radiocirugía y en 2 el tratamiento conservador por decisión del paciente y la familia. En los casos en que la MAV era mayor de 3cms localizada en área elocuente indicamos embolización más cirugía, a no ser que la embolización no fuera técnicamente posible y/o el paciente se presentara con hemorragia causante de sintomatología aguda, en cuyo caso indicamos cirugía como único tratamiento. En las MAV en área no elocuente el tratamiento de elección fue la cirugía. En las MAVs < 3cms localizadas en área elocuente profunda se utilizó la radiocirugía. En 2 casos que se presentaron con hemorragia en área elocuente se decidió adoptar una actitud conservadora por decisión de los pacientes y la familia. Dicha opción no debe ser desestimada; Lawton MT28 en su serie de 174 MAVs grado III, recomienda tratamiento conservador en las MAVs que miden de 3 a 6 cms situadas en área elocuente dado que el tratamiento de las mismas supone un resultado considerado desfavorable en un 14,8%.
En nuestra revisión, las MAVs grado IV fueron tratadas en su mayoría. De 7 pacientes sólo en uno se realizó tratamiento conservador. El factor determinante en la decisión de tomar una actitud terapéutica activa fue la forma de presentación. Se trataron aquéllas que fueron sintomáticas, es decir, las que habían debutado con hemorragia (4 casos) o presentaron crisis resistentes al tratamiento (2 casos).
Hubo un caso que se diagnosticó como hallazgo casual por lo que se optó por tratamiento conservador. La modalidad de tratamiento de elección fue la embolización más cirugía salvo en 3 casos: se indicó cirugía en dos casos, uno de ellos fue una MAV en área no elocuente y el otro caso fue un paciente que ingresó con clínica aguda por sangrado de la MAV. Se realizó embolización parcial en un caso, con el fin de reducir el fenómeno de robo y controlar una epilepsia refractaria.
Tuvimos un caso de MAV grado V que se presentó con crisis comiciales controladas con medicación en el que se decidió realizar tratamiento conservador.
Autores como Han P y Spetzler RF15 en su estudio sobre 73 pacientes con MAVs grado IV y V, tomaron una actitud conservadora en un 75% de los casos ya fueran sintomáticas o no, realizaron tratamiento con embolización parcial en un 10% en aquéllas con fenómenos de robo sintomático, realizaron tratamiento de los aneurismas asociados bien por técnica endovascular o cirugía en un 10% y únicamente realizaron tratamiento completo con embolización más cirugía en un 5%, en aquéllas que habían presentado múltiples hemorragias estableciendo un déficit permanente. Otros grupos neurovasculares también apoyan esta actitud conservadora20,31,32,39. Sin embargo, otros autores como Chang SD4, en su artículo sobre tratamiento de MAVs gigantes (la mayoría grado IV y V), aboga por tratamiento activo siempre que sean sintomáticas aunque con unos resultados dispares: 30% de morbimortalidad y sólo en un 36% de los pacientes se consiguió la obliteración completa de la MAV. Ferch RD y Morgan MK8 en su revisión de 46 MAVs de alto grado, establece dos grupos, 29 MAVs intervenidas quirúrgicamente y 17 tratadas de forma conservadora, objetivando como factor pronóstico de la cirugía, la presencia de aporte arterial profundo. Así, en las MAVs intervenidas con pedículos arteriales profundos obtiene un 44% de morbimortalidad asociada frente a un 11% en las MAVs que no lo presentaban.
Ante tal diversidad de criterios debemos plantearnos si la historia natural de las MAVs de alto grado sin tratar supera la alta morbimortalidad asociada al tratamiento activo. Consideramos el grupo de MAVs sintomáticas aquéllas que se han presentado con hemorragia, crisis resistentes al tratamiento médico o con fenómenos de robo. En estas dos últimas formas de presentación parece que la mayoría de autores está de acuerdo en tratarlas, aunque sea de forma parcial, dado que estos síntomas afectan de forma muy importante la calidad de vida del paciente15,20,31,32. Las MAVs que se presentan con sangrado, como hemos dicho anteriormente, presentan una morbimortalidad por el primer sangrado cercana al 50%2,6,13,30.33,35. Existe un 6 al 18% de riesgo de resangrado sobre todo en los primeros años5,9,11,13,35 y aunque la literatura presenta mucha variabilidad al estimar la morbimortalidad por las siguientes hemorragias, sí parece haber un aumento de la morbimortalidad con los posteriores sangrados. Ondra SL33 analiza el resultado de MAVs sintomáticas y expone que existe un 1,7%/año de morbilidad grave y un 1%/año de mortalidad, es decir, la historia natural de este tipo de MAVs tendría un 2,7%/año de morbimortalidad asociada. Según este dato, si calculamos el riesgo de morbimortalidad acumulado de las MAVs que han sangrado, resulta un 24% de morbimortalidad a los 10 años y un 42% a los 20 años. Por otro lado, los resultados del tratamiento activo de MAVs de alto grado muestran un 7 al 17% de morbimortalidad en las MAVs grado IV y un 12 al 38,4% en las grado V4,8,14,15,19. Analizando estos resultados podemos llegar a la conclusión de que la historia natural, sobre todo en pacientes jóvenes, acaba por presentar una morbimortalidad acumulada superior a la del tratamiento a largo plazo.
Respecto a las MAV no sintomáticas, en especial aquéllas que no han sangrado, no hay evidencia científica de los beneficios de que el tratamiento activo supere al tratamiento conservador. Para ello será interesante conocer los resultados del estudio multicéntrico ARUBA ("A Randomized Trial of Unruptured Brain AVMs"), actualmente en proceso, que compara intervención versus tratamiento conservador de MAVs que no han sangrado1,42.
Aspectos del tratamiento combinado embolización más cirugía
La modalidad terapéutica embolización más cirugía ha significado en las últimas dos décadas la posibilidad de tratar MAVs complejas disminuyendo el alto índice de morbimortalidad que antes presentaban27,29,31,34,38,41.
En el tratamiento de MAVs grado III, IV, incluso V, situadas en área elocuente, con pedículos profundos difíciles de llegar mediante la cirugía, la combinación embolización más cirugía parece la opción más recomendable15,20,27,29,34,38,41.
Según la literatura, el tratamiento endovascular de las MAVs como tratamiento único sin cirugía obtiene una oclusión completa en un 10-40% de los casos12,48,50. Por otro lado, la embolización parcial no parece disminuir el riesgo de sangrado sino que lo aumentaría15,20. Han PP y Spetzler RF15, en su serie de 73 pacientes con MAVs grado IV y V, los pacientes a 8n5/vistas/neuro/v18n5/ se les había realizado embolización parcial tenían un riesgo de 10,4%/año, mientras que los no tratados el riesgo fue de 1,5%/año. Otros autores han observado esta tendencia al sangrado en las MAVs parcialmente ocluidas21,26,46. Por ello, parece que cuando nos proponemos tratar una MAV el objetivo deba ser la exclusión completa de la misma.
El riesgo de sangrado postembolización parece aumentar cuando se apura en la oclusión y nos acercamos a la oclusión completa24. Además no es una técnica exenta de riesgos; en las mejores series se presenta con un 8% de morbilidad permanente y un 1% de mortalidad10.
Si analizamos nuestra experiencia en esta modalidad combinada de tratamiento, vemos que se ha producido un alto porcentaje de sangrado postembolización (4 de 5 casos). Según la literatura actual, la metodología a seguir en este tipo de tratamiento no queda bien establecida. Existe una gran variabilidad sobre el número de sesiones, el intervalo entre procedimientos y el porcentaje de embolización prequirúrgica en los artículos publicados7,10,18,21,22,24,25,26,43,46,49. Debido a ello, presentamos una revisión basada en nuestra experiencia y la literatura sobre los pasos a seguir a la hora de llevar a cabo el tratamiento combinado embolización más cirugía.
1. Número necesario de sesiones de embolización
Los artículos publicados que hablan al respecto ajustan el número de sesiones de embolización a las características de la MAV, al porcentaje de embolización por sesión y al porcentaje de oclusión final que desearíamos obtener antes de la cirugía. Taylor C46, en su artículo, presenta una serie de 201 MAVs embolizadas con una tasa de complicaciones de 9% morbilidad permanente y 2% de mortalidad. Heros R21 recomienda embolizar "poco a poco", ya que se ha visto que embolizar demasiado puede ser un factor de riesgo para que aparezca la hemorragia. De hecho, Taylor C47 afirma que en los últimos años han disminuido el % embolizado en cada sesión y por lo tanto, han aumentado en número de sesiones (de una media de 1,2 sesiones en el año 1993 han pasado a 2,2 en el 2002). Heidenreich18, en su serie de 66 pacientes en los que 7 pacientes presentaron hemorragia postembolización, observa que embolizar > 60% en una sola sesión es un factor de riesgo para presentar sangrado. Howington J22, en su comentario sobre el trabajo de Iwawa T24 (presenta una serie de hematomas postembolización en 605 MAVs embolizadas), recomienda no embolizar más del 50% de la malformación en una sola sesión dado que ello supondría un estrés hemodinámico tal que aumentaría el riesgo de sangrado.
En resumen, el número adecuado de sesiones estará determinado por el porcentaje de embolización prequirúrgica que deseamos conseguir (más adelante comentado), pero teniendo en cuenta que habría que embolizar la lesión "poco a poco" no ocluyendo más de un 50% de la MAV por sesión.
2. Intervalo de tiempo entre sesión y sesión de embolización.
En nuestra serie, el tiempo medio entre sesión y sesión de embolización fue de 14,25+/-5,6 días. En lo publicado en la literatura, no hay datos consistentes sobre cuál es el tiempo adecuado que se debería esperar. Heros R recomienda esperar entre 4 y 6 semanas entre sesiones de embolización21, para dar tiempo a que los cambios hemodinámicos que se producen dentro del nidus tras la oclusión se estabilicen.
3. Porcentaje de embolización prequirúrgica deseable
Varios autores comentan cuál debería ser el porcentaje de embolización preoperatoria óptimo para facilitar la exéresis de la lesión por parte del neurocirujano. Viñuela F49, en su revisión sobre 101 MAVs tratadas con embolización más cirugía, apunta que sería una oclusión superior al 50-75% de la lesión para favorecer la cirugía. Pasqualin F34, en su trabajo sobre 49 pacientes en los que también se realizó tratamiento endovascular más cirugía, señala que un porcentaje de oclusión de la malformación mayor del 40% parece mejorar los resultados de la cirugía. Estos datos podrían dar una idea de cuál es el límite inferior al cual se pretende llegar con el tratamiento endovascular. Por otro lado, el embolizar "demasiado" también tiene sus riesgos; Iwawa T24, en su revisión de 605 MAVs embolizadas, observa que los casos de sangrado postembolización coincide con una oclusión del 70 a más del 95%. Otros autores también apoyan el hecho de la aparición de complicaciones hemorrágicas cuando la lesión está casi completamente excluída21.
4. Intervalo de tiempo entre la última embolización y la cirugía
En nuestra serie, el hecho de que la mayoría de los pacientes presentaron un hematoma postembolización fue lo que motivó el momento de la intervención quirúrgica, por lo que no pudo realizarse de forma electiva. Según la literatura, varios autores abogan por esperar, en la medida de lo posible, entre 1 y 3 semanas entre la última embolización y la cirugía34,43. Esperar más de una semana con el fin de permitir de esta forma la trombosis progresiva de la lesión tras la embolización y disminuir el riesgo de hiperemia en el postoperatorio inmediato. No alargar la cirugía más de 3 semanas, por el riesgo teórico de la formación de vascularización colateral que podría llevarse a cabo. Sin embargo, otros autores como Kuhmomen J y Hernesniemi J25, recomiendan la realización de embolización más cirugía de forma precoz en un total de 4 días, con el fin de evitar un resangrado de la MAV y acelerar la rehabilitación de los pacientes.
Bajo nuestro punto de vista, sería recomendable esperar entre 1 y 3 semanas entre la embolización y la cirugía.
Conclusiones
El tratamiento actual de las malformaciones arteriovenosas cerebrales debe abordarse teniendo un conocimiento preciso de su historia natural, forma de presentación, sus características angioestructurales (presencia de aportes arteriales profundos, aneurismas intranidales), la escala de Spetzler y Martin y el estado clínico del paciente.
Las MAVs grado III y IV tratadas en nuestro centro muestran unos resultados funcionales al año globalmente buenos (93,3% Rankin m ≥ 2), si bien la forma de presentación, fundamentalmente la hemorragia, parece ser un factor determinante en el estado funcional final de nuestros pacientes.
El tratamiento que parece más recomendable en pacientes con MAV grado III, IV, incluso en alguna grado V tratable, situadas en área elocuente y mayores de 3 cms sería la embolización más cirugía. El tratamiento endovascular sería conveniente realizarlo en varias sesiones con oclusión progresiva de la misma, evitando embolizar más del 50% por sesión, con un intervalo entre embolizaciones de entre 4 y 6 semanas y de 1 a 3 semanas entre embolización y cirugía. El porcentaje de oclusión endovascular prequirúrgica deseable sería > 50%, sin pretender buscar una oclusión completa o casi completa, dado que ello podría aumentar el riesgo de sangrado postembolización.








No hay comentarios:
Publicar un comentario